2019 年诺贝尔化学奖授予了三位科学家,即吉野晃、M. Stanley Whittingham 和 John B. Goodenough,他们开发了“锂离子电池”。这些锂离子电池本质上是可充电的,如今已用于所有便携式电子设备,并且确实彻底改变了能源生产和存储的概念。这些电池的独特之处在于它们独立于不可再生能源。本文主要关注原电池,因此让我们详细讨论一下。
在此处了解有关浓缩池的更多信息。
原电池
现在,需要仔细研究一项如此重要的发明。那么,让我们了解一下究竟什么是锂离子电池?
锂离子电池是一种可充电电池,既可以用作原电池(在放电期间),也可以用作电解电池(在充电期间)。与此主题相关的一些重要术语是:
- 电化学电池:能够从化学能中产生电能的电池,反之亦然。电化学电池有两种类型。即,原电池和电解电池。
- 原电池:一种可以从化学能中产生电能的电化学电池。
- 电解电池:这些电池利用电能进行非自发的氧化还原反应。即,它们从电能产生化学反应。
也被称为伏打电池,分别以 Luigi Galvani 或 Alessandro Volta 命名。如上所述,伏打电池将化学能转化为电能。这里给出了一个简单的伏打电池图。它是一种 Zn-Cu 伏打电池,也称为丹尼尔电池。
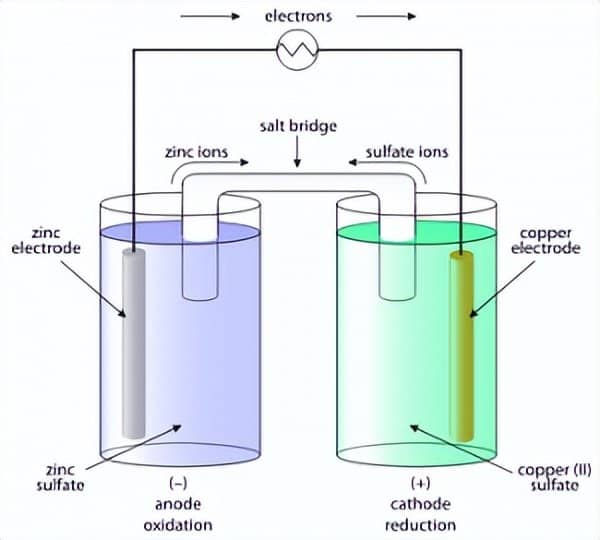
原电池部件
原电池的部件描述如下:
- 电极:分别发生氧化和还原的阳极和阴极的组合名称。
- 电解质:有助于离子运动的化合物的水溶液。
- 盐桥:是连接两个半细胞的桥梁,由琼脂组成。
- 电压表:用于测量闭合电路中电压的装置。
在此处阅读有关电极电位的更多信息。
原电池的工作
原电池由通过盐桥连接的两个半电池组成,每个半电池由浸入电解质中的电极组成。让我们以丹尼尔电池的具体例子来解释原电池的工作原理。
在丹尼尔电池中,锌电极浸入硫酸锌溶液中,铜电极浸入硫酸铜溶液中。一旦这两个半电池连接起来,氧化还原反应就开始了。在锌电极上,发生氧化并开始缓慢溶解在水性介质中,从而减小其尺寸。以下反应发生在阳极上。
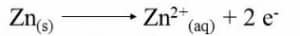
因此在该氧化半电池中产生的电子通过外部电路传播并到达还原半电池。在这里,铜离子吸收这些电子形成中性铜原子,最终沉积在铜棒上。随着时间的推移,您会看到阴极棒的尺寸开始增加。在还原半电池中发生的反应是:
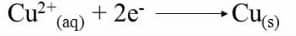
电动势是由电子的运动产生的,因此取决于电解质和电极。整体氧化还原反应为:

产生的 EMF 可以通过以下方式计算:
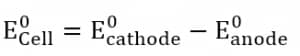
关于原电池的总结说明
- 有两种类型的电化学电池。原电池,也称为伏打电池和电解电池。
- 原电池将化学能转化为电能。
- 原电池的组成部分是电极、电解质、伏安计和盐桥。
- 氧化发生在阳极,还原发生在阴极。







